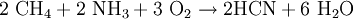- A 100 aranyat érő fű
- Az utolsó gyógyító
- Bodorrózsával a vírusok és baktériumok ellen
- Medvehagyma jótékony hatása
- TOP 7 gyógynövény Influenza ellen
- TOP 8 Immunerősítő gyógynövény
- Mire jó a Bajkáli csucsóka?
- Teakeverékek cukorbetegségre
- Gyömbér mint természetes fájdalomcsillapító
- Univerzális fűszer, mely gyógyít
- Gurmar a cukorbetegek megmentője
- Görögszéna a 2-es típusú cukorbetegség megelőzésére
- Cukorbetegség
Hidrogén-cianid

A hidrogén-cianid (régies nevén kéksav) közönséges körülmények között színtelen, könnyen párolgó folyadék. Szaga akeserűmanduláéra emlékeztet. Gőzei nagyon mérgezőek. Szervetlen vegyület, összegképlete HCN. Vízzel, alkohollal és éterrelkorlátlanul elegyedik. A molekulája erősen poláris.
Folyékony halmazállapotban (HCN)2 dimerként van jelen, a hidrogén-cianid molekulák között hidrogénkötések találhatók. Gyenge sav, vizes oldatban kis mértékben disszociál, disszociációjakor cianidionok (CN−) képződnek belőle. A hangyasav nitriljének is felfogható.
Felfedezése, története
A hidrogén-cianidot először Carl Wilhelm Scheele állította elő, 1782-ben. Gay-Lussac tudta először vízmentes állapotban előállítani 1811-ben. Liebig ésWöhler jött rá, hogy kötött állapotban előfordul a keserűmandulában.
Szerkezete[szerkesztés
A hidrogén-cianidnak két tautomeralakja létezik. Az egyik alak a szén hidrogén-nitridjének, a másik a szén amidjának (izo-alak) tekinthető. A két alak között egyensúly áll fenn. Közönséges körülmények között az izo-alak csak körülbelül 1%-ban fordul elő.
A normál alakban a szén és a nitrogénatom között háromszoros kötés található, ez a háromszoros kötés azonban delokalizálódik. Átterjed a szén-hidrogén kötésre, emiatt ez a kötéshossz rövidebb (106,5 pm), mint a metánban a szén-hidrogén kötéstávolság (109,3 pm).
Kémiai tulajdonságai
A hidrogén-cianid meggyújtható, égésekor szén-dioxid, víz, és nitrogén keletkezik. Oxigénnel robbanó elegyet alkot.
Gyenge sav. Alkálifémek hidroxidjaival sókat, cianidokat képez. Az alkáli-cianidok könnyen hidrolizálnak.
Még a szénsavnál is gyengébb sav, ezért a cianidok a levegőben található vízpárából és szén-dioxidból keletkező szénsav hatására is bomlanak. A bomlás során hidrogén-cianid gáz fejlődik, ezért a cianidok keserűmandula szagúak.
Vizes oldatban lassan hidrolizál. A hidrolízisekor ammónium-formiát keletkezik.
Cseppfolyós halmazállapotban könnyen polimerizálódik.
Előállítása
Hidrogén-cianid keletkezik kálium- vagy nátrium-cianid savval való elbontásakor.
Iparilag metánból és ammóniából állítják elő magas hőmérsékleten (1000 K fölött), katalitikus oxidációval.
Képződik ammónium-formiátból foszfor-pentoxiddal való vízelvonással is. (A hidrogén-cianid hidrolízise megfordítható folyamat.) Kálium-[hexaciano-ferrát(II)]-ből (vagy más néven kálium-ferrocianidból) hidrogén-cianid keletkezik, ha közepes töménységű (körülbelül 30%-os) kénsavoldattal reagál.
Szerepe a légköri folyamatokban
Biomassza-égés (erdő-, és bozóttüzek) melléktermékeként, a nitrogéntartalmú komponensek pirolízisével keletkezik. Az acetonitril mellett a légkör egyik legfontosabb természetes eredetű szerves nitrogén tartalmú formájaként azonosították. Annak ellenére, hogy a különböző erdőtüzek esetén, az ily módon kibocsátott HCN mennyisége erősen változó a hidrogén-cianid emisszióját használják a városi és természetes eredetű légszennyezések megkülönbözésére és természetes biomassza égési folyamatok mennyiségi becslésére. A hidrogén-cianid biomasszából származó emissziója 0,6-3,2 Tg (N)/évre becsülhető. Légköri HCN ezenkívül még képződhet villámlások hatásra is.
Légköri hidrogén-cianid ellenáll a közvetlen fotolízisnek és csak kis mennyisége alakul át kémiai úton, mivel az egyik legreaktívabb fotokémiai úton képződő légköri oxidálószerével, a hidroxilgyökkel (OH) szemben is nagy inertséget mutat. Ennek következtében a becsült felezési ideje a légkörben hosszú (334 nap). Mivel a HCN nagyon jól oldódik vízben, a légköri kiürülésének legvalószínűbb mechanizmusa a nedves kimosódás, a légkörből kimosódott HCN feltételezhetően biológiai úton bomlik le. A HCN nedves ülepedésének első lépése a vízpára cseppek vagy felhők jégkristályain bekövetkező adszorpciója.
Szerepe a kémiai evolúcióban
Az fent említett villámlások nemcsak a modern légkörben, hanem az ősi atmoszférában is lejátszódhattak. Ennek feltételezésével végezte el Miller és Urey azokat az úttörő kísérleteket, amelyekkel metán, ammónia és víz felhasználásával elektromos kisülések hatására aminosavakat állított elő. Elterjedt feltételezés, hogy ezen aminosavak polikondenzcióján keresztül képződhettek az első proteinek, azonban az aminosavak csak másodlagos termékei azon polipeptideknek, amelyek a HCN polimerizációjával képződtek.