- A 100 aranyat érő fű
- Az utolsó gyógyító
- Bodorrózsával a vírusok és baktériumok ellen
- Medvehagyma jótékony hatása
- TOP 7 gyógynövény Influenza ellen
- TOP 8 Immunerősítő gyógynövény
- Mire jó a Bajkáli csucsóka?
- Teakeverékek cukorbetegségre
- Gyömbér mint természetes fájdalomcsillapító
- Univerzális fűszer, mely gyógyít
- Gurmar a cukorbetegek megmentője
- Görögszéna a 2-es típusú cukorbetegség megelőzésére
- Cukorbetegség
Foszfor
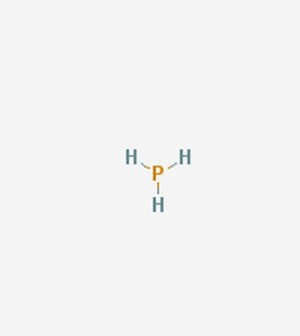
A foszfor (nyelvújításkori magyar nevén vilany) egy nemfémes, szilárd kémiai elem. A rendszáma 15, vegyjele: P . Neve görög eredetű, jelentése „fényhozó”. Az ún. biogén elemek közé tartozik, részt vesz fontos szerves molekulák, például a DNS, RNS felépítésében.
Története
Az elemet először Henning Brandt alkimista állította elő 1669-ben úgy, hogy először napokig vizeletet rothasztott, főzéssel besűrítette, majd a lombikban maradt anyagot vörösizzásig hevítve ledesztillálta, és a keletkező gőzöket víz alatt kondenzáltatta. A keletkező viasz-szerű anyag levegőre kerülve sötétben is világított, láng nélkül. A világító anyagot „hideg tűz”-nek nevezte el. A foszfor szó a görög φως (phos = fény) és φορος (phoros = hordozó) szóból származik. A foszfor egyedülálló az elemek között azzal, hogy először fedezték fel állati/emberi testnedvben, majd utána a növény- és az ásványvilágban, valamint az első elem, melynek ismerjük felfedezőjét.
A foszfor módosulatai
- fehérfoszfor (sárgafoszfor): viasz keménységű, késsel vágható, erősen mérgező anyag, szobahőmérsékleten is hevesen oxidálódik, öngyúlékony. Víz alatt kell tartani, oxigéntől elzárva. Zsírokban, olajokban jól oldódik, ezért nem tanácsos szabad kézzel hozzányúlni, mivel a bőrőn zsír található. Lenyelve már 0,05 g is halálos belőle. Tetraéderes P4 molekulákból épül fel, melyek köbös (α-foszfor) vagy hexagonális (β-foszfor) molekularácsot alkotnak. Át tud alakulni vörösfoszforrá.
- vörösfoszfor: sötétvörös színű amorf por, nem oldódik semmiben, így nem is mérgező. Levegőn eltartható, csak magasabb hőmérsékleten gyullad meg.
- feketefoszfor: sötétszürke, fémesen csillogó, a hőt és a villamosságot jól vezeti, több módosulata (három kristályos és egy amorf). A foszfor termodinamikailag legstabilabb módosulata.
A három foszfor kémiailag azonos módon viselkedik. A foszfor égésekor foszfor-pentoxid keletkezik. A foszfor-pentoxid kiváló vízmegkötő anyag, bőrre kerülve égési sebet okoz.
A foszfor-pentoxid vízzel való reakciójának egyenlete:
Ekkor foszforsav keletkezik. A foszforsav nem mérgező, savanyú ízű anyag, ezért ízesítésre használják. A foszforsav sói a foszfátok, savmaradékionja a foszfátion.
Természetes előfordulása
- A természetben a foszfor legnagyobb része apatitokban és amorf foszfátkőzet-telepeken található. Bár a kitermelés igen nagy (évi 151 millió tonna foszforkőzet, ami 20 millió tonna tiszta foszfornak felel meg), a becslések szerint a jelenlegi felhasználás mellett a telepeken található foszfor több évszázadra elegendő.
- Az emberi szervezetben nagy mennyiségben található (700-800 g/felnőtt). Szükséges a csontok, fogak felépüléséhez, az idegrendszer működéséhez, a fehérje-, szénhidrát-, zsíranyagcseréhez, a fehérjeszintézishez és az enzimek működéséhez.